
PLAN BIMESTRAL
PRIMER BIMESTRE
PROFESORA
ANA PETIT DE GÓNGORA.
Estados de la Materia:
I- Estados Ordinarios de la Materia:
A.- El Estado Gaseoso
a.- Características de los gases
b.- Propiedades de los gases
c.- Tipos de gases
d.- Clasificación de los gases:
d.1- Color de identificación de las botellas para gases
Ejercicio lúdico de teoría
e.- Leyes de los gases
e.1- Ley de Amadeo Avogadro
e.2- Ley de las presiones parciales de John Dalton
e.3- Ley de Roberto Boyle – Mariotte
Ejercicio en parejas de problemas
e.4- Ley de Jacques Charles (1746-1823)
e.5- Leyes de Joseph Gay- Lussac (1778-1850)
e.6- Ley de volúmenes de combinación,
e.7- Ley general de los gases ideales
e.8- Ley de difusión de Thomas Graham
e.9- Desviaciones de las leyes de los gases
B.- El Estado Líquido:
Ejercicio en parejas de teoría
a.- Características Generales de los Líquidos
b.- Tipos de líquidos
b.1- Cristales líquidos
b.1.1- Cristales líquidos nemáticos, esmécticos y colestéricos
b.1.2- Cristales líquidos liotrópicos
b.1.3- Cristales líquidos biológicos
C.- Estado Sólido:
a.- Características Generales
a.1- Expansión muy limitada (a temperatura constante),
a.2- Forma definida
a.3- Volumen constante
a.4- Incompresibilidad
a.5- Densidad alta
Ejercicio lúdico de teoría
a.6- Miscibilidad muy baja
a.7- Rigidez
a.8- Dureza
b.- Propiedades de los sólidos
b.1- Escalares
b.2- Vectoriales
c.- Clasificación de los Sólidos
c.1.- Dependiendo de la forma de la celda unitaria
c.1.1- Sólidos cúbicos centrados en el cuerpo
c.1.2- Sólidos cúbicos centrados en las cara
c.1.3- Sólidos cúbicos regulares o simples
c.1.4- Sólidos tetragonales
c.1.5- Sólidos ortorrómbicos
c.1.6- Sólidos monoclínicos
c.1.7- Sólidos triclínicos
c.1.8- Sólidos romboédrico
Ejercicio en parejas de teoría
c.1.9- Sólidos hexagonales
c.2.- De acuerdo a su forma estructural
c.2.1- Sólidos metálico
c.2.2- Sólidos de red covalente o sólidos macromoleculares
c.2.3- Sólidos moleculares
c.2.4- Sólidos gemelos o maclas
II- Estados Extraordinarios de la Materia
A.- Estado Plasma
B.- Estado Condensado Bosé- Einstein (C. B. E.) o “hielo cuántico”
C.- Estado Superfluido o “Gas degenerado de Fermi”
Desarrollo:
I- Estados ordinarios de la materia:
A. Estado Gaseoso.
a. Características de los gases:
Las características de los gases son:
La Presion de un gas: se origina por el choque de sus moléculas con las paredes del recipiente que lo contiene. Cuanto más moléculas choquen mayor será la presión y cuanto más rápido se muevan (que es lo mismo que estar a mayor temperatura), mayor será la presión.
La Difusion de un gas: esto ocurre cuando hay movimiento de moleculas de una area, en la cual ejerce una presion parcial a una area en donde ejerce presion parcial inferior.
La Expansion de un gas: Un gas no tiene forma ni volumen definidos. Adquiere la forma y el volumen del recipiente en el que se encuentra.
La Densidad de un gas: La densidad es la relación que existe entre la masa de una sustancia y su volumen. En el estado gaseoso es menor que la densidad de la sustancia en estado sólido o estado líquido.
La Comprension de un gas: Es la reduccion o disminucion de los espacios vacios entre las moleculas. Los gases se pueden comprimir esto se da por la presion y temperatura.
1. son fáciles de comprimir.
2 se expanden hasta llenar el contenedor.
3. ocupan mas espacio que los sólidos o líquidos que los conforman.

b. Propiedades de los gases:
Las propiedades son:
Presión:
Es la fuerza por unidad de área. Se trata de la fuerza que ejerce el gas contra las paredes del recipiente que lo contiene. En el caso de los gases, es necesario tomar en cuenta la presión atmosférica, que es “la presión que, a Oo C y al nivel del mar, ejerce sobre una superficie de 1 cm2 una columna de mercurio de 76cm”.
Volumen:
Es el espacio que ocupa un gas.
Temperatura:
Es el nivel calorífico de una sustancia. Generalmente la Tº se da en Kº.
Cantidad:
La cantidad de un gas se puede medir en unidades de masa, usualmente en gramos. De acuerdo con el sistema de unidades SI, la cantidad también se expresa mediante el numero de moles de sustancia, esta puede calcularse dividiendo el peso del gas por su peso molecular.
Densidad:
Es la relación que se establece entre el peso molecular en gramos de un gas y su volumen molar en litros. Se da en gr/L.

c.- Tipos de gases:
Gases corrosivos:Aquel que produce una corrosión de más de 6 mm. Tambien son capaces de atacar a los materiales y destruir los tejidos cutáneos.
Ejemplo: El cloro.
Gases inertes:No arden, no mantienen la combustion y en su seno no es posible la vida.
Ejemplo:Argon, nitrogeno.
Gases combustibles:Arden fácilmente en presencia del aire o de otro oxidante.
Ejemplo: hidrógeno, acetileno.
Gases comburentes: Son indispensables para mantener la combustión.
Ejemplos: oxígeno, protóxido de nitrógeno.
Gases tóxicos: Producen interacciones en el organismo vivo, pudiendo provocar la muerte a determinadas concentraciones.
Ejemplo: monóxido de carbono.

d.- Clasificación de los gases:
◦ Gas comprimido: Gas o mezcla de gases cuya temperatura crítica es menor o igual a - 10º C.
◦ Gas licuado: Gas o mezcla de gases cuya temperatura crítica es mayor o igual a - 10º C.
◦ Gas inflamable: Gas o mezcla de gases cuyo límite de inflamabilidad inferior es menor o igual al 13%, o que tenga un campo de inflamabilidad mayor de 12%.
◦ Gas tóxico: Aquel cuyo límite de máxima concentración tolerable durante 8 horas/día y 40 horas/semana, (T.L.V.), es inferior a 50 ppm.
◦ Gas corrosivo: Aquel que produce una corrosión de más de 6 mm/año, en un acero A33 UNE 36077-73, a una temperatura de 55ºC.
◦ Gas oxidante: Aquel capaz de soportar la combustión con un oxipotencial superior al del aire.
◦ Gas criogénico: Aquel cuya temperatura de ebullición a la presión atmosférica, es inferior a 40ºC.
◦Gas industrial: Los principales gases producidos y comercializados por la industria.
◦ Mezclas de gases industriales: Aquellas mezclas de gases que por su volumen de comercialización y su aplicación, tienen el mismo tratamiento que los gases industriales.
◦Mezclas de calibración:Mezcla de gases, generalmente de precisión, utilizados para la calibración de analizadores, para trabajos específicos de investigación u otras aplicaciones concretas, que requieren cuidado en su fabricación y utilización.

d.1- Color de identificación de las botellas para gases:
◦ Gases inflamables y combustibles: Rojo
◦ Gases oxidantes e inertes: Negro o gris
◦ Gases corrosivos: Amarillo
◦ Gases tóxicos: Verde
◦ Butano y propano industrial: Naranja, otros colores
◦ Mezclas de calibración: Gris

e.- Leyes de los gases:
e.1- Ley de Amadeo Avogadro:
La Ley de Avogadro (a veces llamada Hipótesis de Avogadro o Principio de Avogadro) es una de las leyes de los gases ideales. Toma el nombre de Amedeo Avogadro, quien en 1811 afirmó que:

Esta ley suele enunciarse actualmente también como: "La masa atómica o átomo-gramo de diferentes elementos contienen el mismo número de átomos".
El valor de este número, llamado número de Avogadro es aproximadamente 6,022212 × 1023 y es también el número de moléculas que contiene una molécula gramo o mol . Y el volumen de un mol de gas es de:
| (CL) V=22.4L. |
e.2- Ley de las presiones parciales de John Dalton:
Esta ley establece que la presiónn de una mezcla de gases, que no reaccionan químicamente, es igual a la suma de las presiones parcialess que ejercería cada uno de ellos si solo uno ocupase todo el volumen de la mezcla, sin cambiar la temperatura. La ley de Dalton es muy útil cuando deseamos determinar la relación que existe entre las presiones parciales y la presión total de una mezcla de gases.
 Pt=P1+P2+P3+P4
Pt=P1+P2+P3+P4
e.3- Ley de Roberto Boyle – Mariotte:
A temperatura constante, el volumen de cualquier gas, es inversamente proporcional a la presión a que se somete.


e.4- Ley de Jacques Charles (1746-1823):
Ley de Charles : Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenido a una presión constante, mediante una constante de proporcionalidad directa. En esta ley, Charles dice que a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura el volumen del gas disminuye. Esto se debe a que "temperatura" significa movimiento de las partículas. Así que, a mayor movimiento de las partículas (temperatura), mayor volumen del gas.
e.5- Ley de Joseph Gay- Lussac (1778-1850):
A volumen constante , la presión de un gas es directamente proporcional a la temperatura.

 DespejandoV2
DespejandoV2 
e.6- Ley de volúmenes de combinación:
e.7- Ley general de los gases ideales:
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
Empíricamente, se observan una serie de relaciones entre la temperatura la presión y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Émile Clapeyron en 1834.
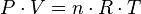

Donde:
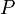 = Presión
= Presión
 = Volumen
= Volumen
 = Moles de Gas.
= Moles de Gas.
 = Constante universal de los gases ideales.
= Constante universal de los gases ideales.
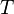 = Temperatura absoluta
= Temperatura absoluta
e.8- Ley de difusión de Thomas Graham:
Las velocidades de difusión de dos gases a la misma temperatura son inversamente proporcional a raíz cuadrada de sus densidades

El peso molecular es proporcional a la densidad.

e.9- Desviaciones de las leyes de los gases:
Las leyes de los gases tiene dos desviaciones ellas son:
La desviación positiva con respecto al comportamiento de las gases ideales, se debe a la molécula de hidrógeno y algunos gases raros; mientras la desviaciones negativas se deben a moléculas mayores, mas aun, los gases reales en general a presiones moderadas presentan desviaciones negativas.
Estas desviaciones positivas y negativas empleando la ecuación de Van er Waals son las siguientes:
La ecuación de Van Waals es:
![]()

B.- El Estado Líquido
a.- Características Generales de los Líquidos:
Un líquido está formado por moléculas que están en movimiento constante y desordenado, y cada una de ellas choca miles de millones de veces en un lapso muy pequeño. Pero, las intensas fuerzas de atracción entre cada molécula, o enlaces de hidrogeno llamados dipolo-dipolo, eluden el movimiento libre, además de producir una cercanía menor que en la que existe en un gas entre sus moléculas.
Además de esto, los líquidos presentan características que los colocan entre el estado gaseoso completamente caótico y desordenado, y por otra parte al estado sólido de un liquido (congelado) se le llama ordenado. Por lo tanto podemos mencionar los tres estados del agua (liquido universal), sólido, gaseoso y liquido.
De lo cual he concluimos a las siguientes características:
b.- Tipos de líquidos
b.1- Cristales líquidos:
El cristal líquido es un tipo especial de estado de agregación de la materia que tiene propiedades de las fases líquida y la sólida. La principal característica de estos compuestos es que sus moléculas son altamente anisótropas en su forma, pueden ser alargadas, en forma de disco u otras más complejas como forma de piña.

b.1.1- Cristales líquidos nemáticos, esmécticos y colestéricos:
Cristales liquidos Nemáticos: los centros de masas de las moléculas están colocados como en un líquido (sin orden de largo alcance) y al menos uno de los ejes principales de las moléculas apunta, en promedio, a lo largo de una determinada dirección (llamada director).
Cristales liquidos Esmécticos: al igual que en la nemática, tenemos orden de largo alcance orientacional y además los centros de masas moleculares están organizados en capas a lo largo de una dimensión. El esméctico, por tanto, presenta también orden de largo alcance posicional en una dimensión.
Cristales Colestéricos:que contienen varias capas de moléculas cuyos ejes son paralelos al plano, pero ligeramente divergentes de una a otra capa, de suerte que los ejes forman estructuras helicoidales perpendiculares al plano. La mayor parte de los cristales líquidos colestéricos son, como su nombre indica, derivados del colesterol; fue este tipo de cristales el que Reinitzer observó. Poseen una propiedad óptica excepcional: el dicroísmo circular que hace que, al recibir un haz luminoso, una longitud de onda se polarice de forma circular y las demás se polaricen y se reflejen, lo cual se traduce en que los cristales colestéricos expuestos a luz blanca presentan irisacionescaracterísticas tanto del ángulo de incidencia como de la temperatura de los cris-tales, irisaciones que se acentúan y varían al elevarse la temperatura de los cristales. Otra particularidad de los cristales colestéricos es que, al enfriarlos, pasan a la fase esméctica.
![]() Cristales Colestericos.
Cristales Colestericos.
 Cristales Esmecticos.
Cristales Esmecticos.
Cristales Nematicos.
b.1.2- Cristales líquidos liotrópicos:
Formados por agregados de moléculas anfifílicas (moléculas que poseen en su misma estructura, regiones hidrofóbicas e hifrofílicas) cuando son colocadas en un medio polar (agua) o apolar (solvente orgánico).

b.1.3- Cristales líquidos biológicos:
En particular, las membranas biológicas y las membranas de las células son una forma de cristal líquido. Sus moléculas dispuestas en forma de barra (por ejemplo, los fosfolípidos o las lecitinas) son organizadas perpendicularmente a la superficie de la membrana, mas la membrana es líquida y elástica. Las moléculas del componente pueden fluir fácilmente, pero tienden a no salir de la membrana, y pueden desplazarse de un lado a otro de la membrana con alguna dificultad. Estas fases del cristal líquido en la membrana pueden recibir e introducir las proteínas importantes como si fuesen libremente receptores "flotantes", o por fuera de la membrana. Muchas otras estructuras biológicas exhiben la conducta de cristal líquido. Por ejemplo: la solución concentrada de la proteína que es arrojada por una araña para generar seda es, de hecho, una fase del cristal líquido. El orden preciso de las moléculas en la seda es crítico para darle su conocida fuerza. El ADN y muchos polipéptidos conforman fases de cristal líquido.
C.- Estado Sólido
a.- Características Generales:
Los cristales poseen una constitución vectorial, es decir, sus propiedades son función de la dirección En las sustancias cristalinas no son equivalentes todas las direcciones. La dependencia entre las propiedades de un cristal y la dirección está influenciada por la simetría del mismo, es decir por el número de planos o de ejes de simetría que son los que condicionan el crecimiento del cristal.

a.1- Expansión muy limitada (a temperatura constante):
Los Solidos no se expanden en forma infinita como los gases.

a.2- Forma definida:
Forma definida: Tienen forma definida, son relativamente rígidos y no fluyen como lo hacen los gases y los líquidos, excepto a bajas presiones extremas.
a.3- Volumen constante:
Debido a que tienen una forma definida, su volumen también es constante.

a.4- Incompresibilidad:
Consiste en que las moleculas de los solidos tienen un determinado orden lo cual no permite que por accion de la presion estos reduzcan su volumen a uno menor.

a.5- Densidad alta:
Los sólidos tienen densidades relativamente altas debido a la cercanía de sus moléculas por eso se dice que son más “pesados”

a.6- Miscibilidad muy baja:
Miscibilidad es un término usado en química que se refiere a la propiedad de algunos solidos para mezclarse en cualquier proporción, formando una solución homogénea En principio, el término es también aplicado a otras fases (liquidos, gases), pero se emplea más a menudo para referirse a la solubilidad de un líquido en otro. El agua y el etanol(alcohol etilico), por ejemplo, son miscibles en cualquier proporción.

a.7- Rigidez:
Es la capacidad de un objeto sólido o elemento estructural para soportar esfuerzos sin adquirir grandes deformaciones o desplazamientos.

a.8- Dureza:
Un sólido es duro cuando no puede ser rayado por otro más blando. El diamante es un sólido con dureza elevada.

b.- Propiedades de los sólidos
b.1- Escalares:

b.2- Vectoriales:

c.- Clasificación de los Sólidos
c.1.- Dependiendo de la forma de la celda unitaria:

c.1.1- Sólidos cúbicos centrados en el cuerpo:
Estructura cúbica centrada en el cuerpo:
Cada átomo de la estructura, está rodeado por ocho átomos adyacentes y los átomos de los vértices están en contacto según las diagonales del cubo
Estructura cúbica centrada en las caras
Está constituida por un átomo en cada vértice y un átomo en cada cara del cubo. Los metales que cristalizan en esta estructura son: hierro gama, cobre, plata, platino, oro, plomo y níquel.


c.1.2- Sólidos cúbicos centrados en las cara:
Estructura cúbica centrada en las caras:
Cada átomo está rodeado por doce átomos adyacentes y los átomos de las caras están en contacto.
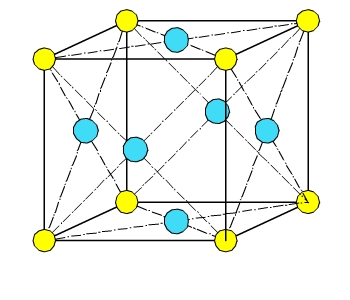
c.1.3- Sólidos cúbicos regulares o simples:

c.1.4- Sólidos tetragonales:


c.1.5- Sólidos ortorrómbicos:
Son los que poseen 3 ejes de longitud desigual que se interceptan en ángulos rectos.

c.1.6- Sólidos monoclínicos:
Solido monoclínica: es un sistema cristalino que consta de un eje binario, un plano perpendicular a éste y un centro de inversión. La denotacion de la red monoclinica es 2/m. Tambien
posee tres ejes de longitud desigual; de los cuales 2 de ellos se interceptan a ángulos rectos y un tercero es perpendicular a uno y no al otro.
c.1.7- Sólidos triclínicos:
Los cristales triclínicos muestran la menor simetría con respecto a todos los sistemas cristalinos. Sus ejes son desiguales y nunca forman ángulos rectos. Un ejemplo de mineral que cristaliza en este sistema es la cianita o distena.

c.1.8- Sólidos romboédrico:

c.1.9- Sólidos hexagonales:
Que tiene seis ángulos.

c.2.- De acuerdo a su forma estructural
c.2.1- Sólidos metálico:

c.2.2- Sólidos de red covalente o sólidos macromoleculares:
Las redes covalentes (o sólidos covalentes) son sustancias de tipo macromolecular, es decir, formadas por un número muy elevado de átomos iguales o distintos, unidos entre sí. Se trata de cristales cuyos átomos se enlazan covalentemente.
En general, están formadas a partir de carbono o de silicio. El primero se presenta en forma de diamante (átomos de carbono unidos en las tres direcciones del espacio con geometría sp3), o grafito (átomos de carbono con geometría sp2 formando hexágonos unidos en dos direcciones formando láminas), mientras que el segundo lo hace como sílice (SiO2) que forma minerales como cuarzo, ópalo, etc., e incluso la arena de las playas. Su estructura es tetraédrica con el silicio como átomo central.
Como consecuencia se hará preciso diferenciar las propiedades según a qué tipo de compuestos se refieran.


c.2.3- Sólidos moleculares:
En los sólidos moleculares, las moléculas ocupan en el retículo cristalino una posición fija en el ordenamiento interno del sólido.
Las moléculas apolares y simétricas que tengan forma aproximadamente esférica, tienen corrientemente estructuras de empaquetamiento compacto de las moléculas. En algunos casos la estructura se aparta ligeramente de dicho tipo, pero se pueden describir aproximadamente de esa manera.
Enlace en los sólidos moleculares.
Las fuerzas de unión de las moléculas en un sólido molecular son llamadas en general Fuerzas de van der Waals. En la inmensa mayoría de los casos estas fuerzas son débiles y de esto se derivan muchas de las propiedades del sólido.
Las Fuerzas de van der Waals son de origen electrostático.
Cuando son moléculas polares, es evidente que la interacción entre los dipolos eléctricos de una molécula con las otras es decisiva.
Cuando son apolares, el origen de las fuerzas de atracción es algo menos evidente, pero se relaciona con la existencia de la envoltura electrónica de carga negativa de una molécula y su interacción con otras..


c.2.4- Sólidos gemelos o maclas:
Los sólidos iónico o gemelos presentan altos puntos de fusión y de ebullición. No conducen sino en estado fundido o próximo a la fusión y son solubles en disolventes polares: NaCl, MgO, CaCO3.

II- Estados Extraordinarios de la Materia
A.- Estado Plasma:
Se denomina plasma a un gas constituido por partículas cargadas (iones) libres y cuya dinámica presenta efectos colectivos dominados por las interacciones electromagnéticas de largo alcance entre las mismas. Con frecuencia se habla del plasma como un estado de agregación de la materia con características propias, diferenciándolo de este modo del estado gaseoso, en el que no existen efectos colectivos importantes.
La frecuencia de plasma:
Así como la longitud de Debye proporciona una medida de las longitudes típicas en un plasma, la frecuencia de plasma (ωp) describe sus tiempos característicos. Supóngase que en un plasma en equilibrio y sin densidades de carga se introduce un pequeño desplazamiento de todos los electrones en una dirección. Éstos sentirán la atracción de los iones en la dirección opuesta, se moverán hacia ella y comenzarán a oscilar en torno a la posición original de equilibrio. La frecuencia de tal oscilación es lo que se denomina frecuencia de plasma. La frecuencia de plasma de los electrones es:

donde me es la masa del electrón y e su cargaa
Por lo general las partículas de una determinada especie localizadas en un punto dado no tienen igual velocidad: presentan por el contrario una distribución que en el equilibrio térmico es descrita por la distribución de Maxwell-Boltzmann .A mayor temperatura, mayor será la dispersión de velocidades (más ancha será la curva que la representa).
Una medida de tal dispersión es la velocidad cuadrática media que, en el equilibrio, se denomina también velocidad térmica. Es frecuente, aunque formalmente incorrecto, hablar también de velocidad térmica y de temperatura en plasmas lejos del equilibrio termodinámico. En tal caso, se menciona la temperatura que correspondería a una velocidad cuadrática media determinada. La velocidad térmica de los electrones es:

Modelos teóricos:
Tras conocer los valores de los parámetros descritos en la sección anterior, el estudioso de los plasmas deberá escoger el modelo más apropiado para el fenómeno que le ocupe. Las diferencias entre diferentes modelos residen en el detalle con el que describen un sistema, de modo que se puede establecer así jerarquía en la que descripciones de nivel superior se deducen de las inferiores tras asumir que algunas de las variables se comportan de forma prescrita. Estas asunciones o aproximaciones razonables no son estrictamente ciertas pero permiten entender fenómenos que serían difíciles de tratar en modelos más detallados.
Por supuesto, no todas las especies han de ser descritas de una misma forma: por ejemplo, debido a que los iones son mucho más pesados que los electrones, es frecuente analizar la dinámica de los últimos tomando a los iones como inmóviles o estudiar los movimientos de los iones suponiendo que los electrones reaccionan mucho más rápido y por tanto están siempre en equilibrio termodinámico.
Puesto que las fuerzas electromagnéticas de largo alcance son dominantes, todo modelo de plasma estará acoplado a las ecuaciones de Maxwell, que determinan los campos electromagnéticos a partir de las cargas y corrientes en el sistema.
Los modelos fundamentales más usados en la física del plasma, listados en orden decreciente de detalle, es decir de microscópicos a macroscópicos, son los modelos discretos, los modelos cinéticos continuos y los modelos de fluidos o hidrodinámicos.
El máximo detalle en el modelado de un plasma consiste en describir la dinámica de cada una de sus partículas según la segunda ley de Newton. Para hacer esto con total exactitud en un sistema de N partículas habría que calcular del orden de N2 interacciones. En la gran mayoría de los casos, esto excede la capacidad de cálculo de los mejores ordenadores actuales.
Sin embargo, gracias al carácter colectivo de los plasmas, reflejado en la condición de plasma, es posible una simplificación que hace mucho más manejable el cálculo. Esta simplificación es la que adoptan los llamados modelos numéricos Particle-In-Cell (PIC; Partícula-En-Celda): el espacio del sistema se divide en un número no muy grande de pequeñas celdas. En cada instante de la evolución se cuenta el número de partículas y la velocidad media en cada celda, con lo que se obtienen densidades de carga y de corriente que, insertadas en las ecuaciones de Maxwell permiten calcular los campos electromagnéticos. Tras ello, se calcula la fuerza ejercida por estos campos sobre cada partícula y se actualiza su posición, repitiendo este proceso tantas veces como sea oportuno.
Los modelos PIC gozan de gran popularidad en el estudio de plasmas a altas temperaturas, en los que la velocidad térmica es comparable al resto de velocidades características del sistema.
Cuando la densidad de partículas del plasma es suficientemente grande es conveniente reducir la distribución de las mismas a una función de distribución promediada. Ésta representa la densidad de partículas contenida en una región infinitesimal del espacio de fases
es decir el espacio cuyas coordenadas son posiciones y cantidades de movimiento. La ecuación que gobierna la evolución temporal de las funciones de distribución es la ecuación de Boltzmann. En el caso particular en el que las colisiones son despreciables la ecuación de Boltzmann se reduce a la ecuación de Vlasov.
Los modelos físicos cinéticos suelen emplearse cuando la densidad numérica de partículas es tan grande que un modelado discreto resulta inabordable. Por otra parte, los modelos cinéticos constituyen la base de los estudios analíticos sobre plasmas calientes.
Para plasmas a bajas temperaturas, en los que estudiamos procesos cuyas velocidades características son mucho mayores que la velocidad térmica del plasma, podemos simplificar el modelo y asumir que todas las partículas de una especie en un punto dado tienen igual velocidad o que están suficientemente cerca del equilibrio como para suponer que sus velocidades siguen la distribución de Maxwell-Boltzmann con una velocidad media dependiente de la posición. Entonces se puede derivar unas ecuaciones de fluidos para cada especie que, en su forma más general, son llamadas ecuaciones de Navier-Stokes Lamentablemente en muchos casos estas ecuaciones son excesivamente complejas e inmanejables; hay que recurrir entonces a simplificaciones adicionales.
Los plasmas forman el estado de agregación más abundante de la naturaleza. De hecho, la mayor parte de la materia en el Universo visible se encuentra en estado de plasma. Algunos ejemplos de plasmas son:
B.- Estado Condensado Bosé- Einstein (C. B. E.) o “hielo cuántico”:
Condensado de Bose - Einstein:
En 1920, Santyendra Nath Bose desarrolló una estadística mediante la cual se estudiaba cuándo dos fotones debían ser considerados como iguales o diferentes. Envió sus estudios a Albert Einstein, con el fin de que le apoyara a publicar su novedoso estudio en la comunidad científica y, además de apoyarle, Einstein aplicó lo desarrollado por Bose a los átomos. Predijeron en conjunto el quinto estado de la materia en 1924.
No todos los átomos siguen las reglas de la estadística de Bose-Einstein. Sin embargo, los que lo hacen, a muy bajas temperaturas, se encuentran todos en el mismo nivel de energía.
Explicación Intutiva:
Es difícil entender intuitivamente qué significa el Condensado de Bose-Einstein (CBE). En el CBE, todos los átomos se encuentran en el mismo lugar, aunque esto va en contra de todo lo que vemos a nuestro alrededor.
A las temperaturas increíblemente bajas que se necesitan para alcanzar el estado de condensado de Bose-Einstein, se observa que los átomos pierden su identidad individual y se juntan en una masa común que algunos denominan superátomo.

Figura 1
El la figura 1 hemos considerado una visión intuitiva de la estructura de un átomo representando el núcleo (formado por protones y neutrones) por una bolita maciza roja, y la corteza de electrones que lo rodean por una bola hueca roja también. La bola con un punto en el centro constituye un átomo completo eléctricamente neutro.
Estado Sólido: podemos ver que los átomos se hallan dispuestos en un volumen pequeño, se sitúan adyacentes, uno al lado del otro, aunque no en contacto, formando generalmente una estructura.
Estado Líquido: los átomos se encuentran esparcidos en un volumen mayor, sin seguir ninguna estructura. La separación entre cada átomo es mayor que en el sólido.
Estado Gaseoso: los átomos ocupan un volumen mucho mayor. Es el estado en que los átomos están más separados.
Estado de Plasma: sus componentes no son átomos, sino partículas individuales y núcleos de átomos. Parece un gas, pero formado por iones (cationes -núcleos y protones con carga positiva-, neutrones sin carga y electrones -con carga negativa-). Cada componente del estado de plasma está cargada eléctricamente y el conjunto ocupa un gran volumen.
Condensado de Bose-Einstein: todos los átomos se encuentran en un mismo lugar. En la figura 1, la única bola roja representa la posición donde se hayan todos lo átomos, pero no uno sobre otro, sino todos ocupando el mismo espacio físico.
Para hacernos una idea de lo que sería un objeto cotidiano estando en estado de Bose-Einstein, proponemos imaginar que varias personas estuvieran sentadas en la misma silla, no una sentada sobre otra, sino literalmente todas sentadas en la misma silla, ocupando el mismo espacio en el mismo momento.
¿Cuán frío debe estar el condensado de Bose-Einstein?
La temperatura es una medida del movimiento de los átomos de un sistema. Si lo que se desea es parar los átomos, deberemos bajar la temperatura lo máximo posible con el fin de alcanzar el valor más cercano al cero absoluto (0 K).
La temperatura más baja que se encuentra de forma natural en el universo es de 3 K, que corresponde a la radiación de fondo. Ésta es una radiación uniforme y de baja energía que se encuentra en cualquier dirección del universo.
Para conseguir el CBE es necesario enfriar los átomos a una temperatura muchísimo menor. Normalmente se han usado átomos de rubidio o sodio y se han debido enfriar a una temperatura de 0,000 000 001 K !!!
Se ve como una pequeña masa en el fondo de una trampa magnética. Como una gota de agua que se condensa cuando se enfría el aire.

Los tamaños obtenidos de CBE más grandes son del tamaño de una pepita de melón. En la generación de un condensado de Bose-Einstein, como aún suele haber átomos normales alrededor, el condensado suele mostrarse como si fuera la semilla dentro de una cereza.

En principio, un condensado de Bose-Einstein se puede mirar con nuestros ojos en el experimento. Sin embargo, como suele ser pequeño, tendríamos que usar un microscopio e iluminar la muestra con luz, con lo que le volveríamos a comunicar energía (y por lo tanto temperatura), se calentarían y volverían a ser átomos normales de gas.
Como Weiman y Cornell lo vieron por primera vez fue apagando la máquina durante un instante y tomando una fotografía.
La imagen más famosa de la formación del condensado de Bose-Einstein es una imagen que recoge los datos tomados por estos científicos a medida que la temperatura decrecía.
C.- Estado Superfluido o “Gas degenerado de Fermi:
Un gas degenerado de Fermi es una colección macroscópica de átomos tal que las partículas que lo componen se encuentran arregladas de menor a mayor valor en la escala de energía. Así, la partícula en el estado de más baja energía posee energía igual a cero, y la partícula que se encuentra en el estado más alto tiene una energía denominada energía de Fermi. El hecho de que los fermiones se distribuyan de esta forma, es una consecuencia de la imposibilidad de dos fermiones de ocupar el mismo estado cuántico. En la Figura 2 se ilustra esquemáticamente el arreglo energético para formar un gas degenerado de Fermi. Sin embargo, aunque de manera similar al caso de los bosones, no es posible llegar al cero absoluto de la temperatura, el fenómeno se puede observar a temperaturas muy bajas. Se ha encontrado en el laboratorio que las temperaturas necesarias para obtener un gas degenerado de Fermi son comparables a las que dan lugar a la Condensación en un gas de Bose, es decir solo algunas millonésimas de grado kelvin por encima del cero absoluto.
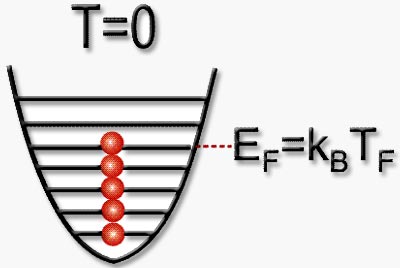 |
Figura 2. Se ilustra esquemáticamente el arreglo energético de un gas de fermiones cuando este tiene la menor temperatura posible y se forma un gas degenerado de Fermi. La energía EF se conoce como energía de Fermi y corresponde a la energía del átomo situado en la parte más alta de este arreglo. |
En un laboratorio, la imposibilidad de los fermiones de ocupar el mismo estado se traduce en la dificultad para enfriar un gas de Fermi. Como se ha explicado antes, el mecanismo último durante el proceso de enfriamiento de un gas atómico son las colisiones entre pares de partículas, ya que es a través de estos choques que el gas llega a un estado de equilibrio en el que la temperatura del sistema completo disminuye. Sin embargo, en un gas de Fermi, esta situación no se produce de forma natural debido a que de manera efectiva los fermiones presentan una especie de repulsión entre ellos, como consecuencia del Principio de Exclusión de Pauli, y esto impide que las partículas interactúen a través de colisiones. Por tal motivo, el mecanismo que se empleó en el laboratorio para producir por primera vez un gas degenerado de Fermi fue combinar un gas de Fermi, a la temperatura mínima que se podía alcanzar utilizando las técnicas de enfriamiento explicadas antes, con un gas de bosones a temperatura mas baja, de tal forma que los fermiones pudieran chocar con los bosones menos energéticos, logrando de manera global disminuir la temperatura del gas de Fermi.
No fue sino hasta 1999 cuando se produjo un gas degenerado de Fermi utilizando esta técnica que se conoce como “enfriamiento asistido”.
En la Figura 3 se ilustra una fotografía que representa este proceso, en ella se observan dos nubes, una exterior y otra interior. La nube exterior corresponde a un gas de Fermi, el cual después de haber estado en contacto con la nube interior, que es un gas de Bose a más baja temperatura, adquiere la misma temperatura que este último.
Figura 3. Se observan las fotografías correspondientes a nubes de átomos en el proceso que conduce a la formación de un gas degenerado de Fermi. La nube exterior es un gas de fermiones y la nube interior es un gas de bosones con una temperatura cercana a la temperatura crítica. La temperatura del gas de fermiones disminuirá como consecuencia de la interacción con el gas de bosones.
Después de la realización del gas degenerado de Fermi, el siguiente reto, y que es actualmente objeto de estudio de los gases atómicos, es la manipulación de la interacción entre pares de partículas a través del uso de campos magnéticos. Esta idea surgió debido a que el tipo de átomos usados para producir gases atómicos ultrafríos son extremadamente sensibles a la aplicación de un campo magnético, como se mencionó anteriormente. De manera paralela, la teoría desarrollada en el estudio de colisiones de partículas a bajas temperaturas predice que para un valor determinado de la interacción entre pares de partículas, existe la posibilidad de formar moléculas compuestas de dos fermiones. La relevancia del estudio de la dinámica de un gas ultrafrío de moléculas formadas por pares de fermiones, es que estas moléculas son precursoras del llamado estado superconductor. Un superconductor es un material que no ofrece resistencia eléctrica al paso de una corriente a través de él.
Durante mucho tiempo se había propuesto que los fenómenos de superconductividad y condensación de Bose están relacionados de forma muy cercana. La hipótesis detrás de esta suposición es que ambos fenómenos son dos ejemplos extremos de un comportamiento superfluído, el cual es un estado de la materia que no presenta resistencia al fluir. Por ejemplo cuando se coloca helio líquido superfluído en el centro de un contenedor abierto, éste espontáneamente tenderá a fluir hacia las paredes del contenedor. Tanto el estado superconductor como el superfluído abren la puerta tanto a nuevas formas de estudio de la materia como a posibles aplicaciones prácticas.
